碳氧化合物——一氧化碳
概述
一氧化碳(carbon monoxide)是一种无色、无味、无刺激性的无机小分子气体。在水中的溶解度极低,极难溶于水。空气混合爆炸极限为12.5%~74%。一氧化碳进可以和人体血液中的血红蛋白结合并产生碳氧血红蛋白,从而使人体内的各个组织细胞缺氧,严重时会导致死亡,具有一定毒性。由于一氧化碳无色、无味,故在日常生活中容易被忽略从而存在极大的安全隐患。尤其是家中居室通风性较差时煤气和液化气泄漏或矿井中一氧化碳泄漏,造成的影响最大。1846年,法国的生理学家Claude Bernard为了对一氧化碳的毒性进行研究,让狗吸入了一氧化碳气体后,发现狗的血液颜色会变得更鲜艳。后来我们就用血液变鲜红这一现象来作为一氧化碳中毒的一种临床表现。

一氧化碳,通常状况下为是无色、无臭、无味的气体。
分子结构
CO分子是由一个C原子和一个O原子结合成的异核双原子分子,分子形状为直线形。
而按照分子轨道法(分子轨道理论),可以自然地得到CO分子具有三重键的结构。按照分子轨道法,CO分子轨道是由C原子轨道和O原子轨道组合而成的,CO分子轨道形成式为:
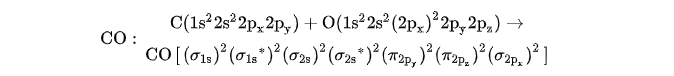
性质
物理性质上,一氧化碳的熔点为-205℃,沸点为-191.5℃,难溶于水(20℃时在水中的溶解度为0.002838g),不易液化和固化。化学性质上,一氧化碳既有还原性,又有氧化性,能发生氧化反应(燃烧反应)、歧化反应等。
应用领域
化学工业、冶金工业、此外,一氧化碳常用于鱼、肉、果蔬及袋装大米的保鲜,特别是生鱼片的保鲜,又因可以使肉质品色泽红润而被作为颜色固定剂。
传感器
基本原理
红外光谱吸收型光纤一氧化碳传感器是根据每种气体的固有吸收光谱,当被检测的气体吸收波长和传感器中光源的发射波长吻合时,会发生共振吸收现象。
煤矿一氧化碳传感器的改造
改造后的系统主要由光源、传感器、光电转换部分、数据处理部分和锁相滤波部分组成。其中,光源部分、传感器、光电转换部分采用模拟电路,检测数据处理部分采用数字电路。
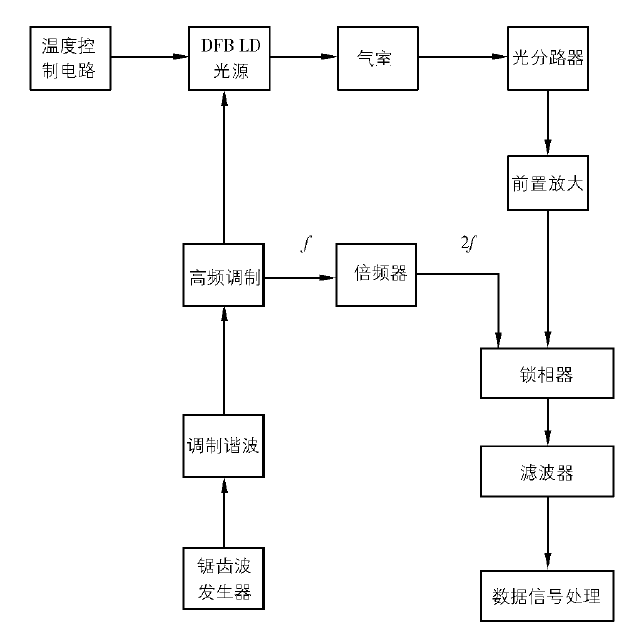
改造后一氧化碳传感器系统原理图
中毒
诊断
一般情况下,一氧化碳中毒的诊断依据与其他方式中毒存在相似之处,如是否曾经有过毒物接触史、常见的临床表现及实验室检查等,但是一氧化碳中毒与其他中毒存在差异,一氧化碳中毒的患者其临床表现呈现多样性,一氧化碳的来源比较广泛,所有易燃物发生不完全燃烧均能产生一氧化碳,由此,在对此类患者进行诊断时,需要仔细询问患者的情况及发病史等,有利于尽早进行诊断。一般常见的一氧化碳中毒表现是头痛、头昏及意识障碍等。据报道,存在3%~13%的一氧化碳患者的主要临床表现是昏迷,出现一氧化碳中毒时,大部分患者的肌张力出现异常的上升,其腱反射出现明显的亢进现象,因此,对于出现昏迷的患者而言,应该考虑是否存在一氧化碳中毒的可能性。实验室检查方面,呼出气与血液中的一氧化碳浓度具有明显的相关性,对于疑似一氧化碳中毒的患者,检测其血液碳氧血红蛋白的浓度,对诊断有一定的价值,但是其易受到检测时间及接受氧疗的影响,因此,目前只是作为定性诊断指标之一。对于不存在吸烟史的患者,如果血液碳氧血红蛋白的浓度>10%,需要考虑是否存在一氧化碳中毒的可能。
机制
缺血缺氧学说是一氧化碳中毒的经典学说之一,一氧化碳与血红蛋白高度亲和,造成血红蛋白携带氧能力下降,在线粒体中,一氧化碳直接与细胞色素C氧化酶或间接与细胞色素P450系统中的酶结合,造成呼吸链传递障碍,氧气利用困难,导致组织缺氧,当一氧化碳中毒导致心脏损伤引起低血压时,脑动脉供血不足,脑组织缺血,一氧化碳继发缺氧会造成大脑皮质、白质、海马、基底核等部位损伤,进而影响患者的临床症状,氧化应激也是一氧化碳中毒的机制之一。一氧化碳可与离子通道、可溶性鸟苷酸环化酶、一氧化氮、一氧化氮合酶、线粒体、细胞色素、还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶以及黄嘌呤氧化酶相作用,产生活性氧类包括过氧化氢、臭氧、一氧化氮等,ROS产生过多或抗氧化防御系统失衡可能导致细胞损伤以及细胞信号转导通路的广泛破坏。因此,体内氧化剂/抗氧化剂失衡可能在一氧化碳毒性中具有重要的病理生理学作用。
也有学者将急性一氧化碳中毒损伤归因于交感神经末梢分泌增加,导致儿茶酚胺危象,进而使中脑边缘系统包括苍白球多巴的水平升高,造成急性神经损伤,一氧化碳中毒使深部白质的突触或少突胶质细胞中的儿茶酚胺(去甲肾上腺素/多巴胺)持续在较高水平,导致轴突损伤或继发性髓鞘损伤,最终导致深部白质神经损伤延迟,影响尾状核,可能导致帕金森样症状。
此外,一氧化碳中毒也可能与免疫反应有关,THOM等认为,一氧化碳中毒导致脂质过氧化物丙二醛产生,丙二醛可与髓鞘碱性蛋白形成丙二醛MBP加合物,引起免疫反应,随着巨噬细胞和CD4淋巴细胞的流入以及活化小胶质细胞的增加MBP将失去其正常的阳离子特征,导致蛋白酶攻击增强,抗体识别能力受到影响,从而产生相应的免疫炎症反应,造成患者神经症状改变。
治疗
高压氧治疗
目前最有效的治疗一氧化碳中毒的方法为HBOT,高压氧舱中的压力大于大气压,可将氧气通过呼吸道压入肺组织,通过增加气压或氧分压发挥治疗作用。
在正常大气环境中,COHB的半衰期为320min,而HBOT可将COHB的半衰期降至20min,第10届欧洲高压医学共识会议一氧化碳中毒的Ⅰ级推荐治疗方案如下:
1.应用HBOT。在院前急救治疗中给予所有一氧化碳中毒患者应用100%氧气。
2.无论COHB水平如何对于入院时已经出现意识、循环、呼吸改变以及精神心理症状的患者应予以HBOT。
3.无论COHB水平及临床症状如何,对于所有一氧化碳中毒的孕妇均应进行HBOT。
4.不推荐暴露于一氧化碳环境超过2412h的无症状患者接受HBOT,Ⅲ级推荐认为12h常压氧或HBOT治疗轻度一氧化碳中毒患者是合理的huang等的回顾性研究指出,已接受≥2次HBOT的一氧化碳中毒患者的死亡率低于仅接受1次HBOT的患者,特别是年龄<20岁和急性呼吸衰竭患者HBOT可减少一氧化碳中毒后的神经心理后遗症,但目前关于其预防心肌损伤的研究较少,一项回顾性研究指出在一氧化碳中毒后22.5h内接受HBOT能够有效预防DEEADEACMP的发生,另有病例报道显示HBOT后可发生非惊觉性癫痫持续状态,如果HBOT后患者的精神状态未见好转,应立即完善脑电图检查,以除外癫痫持续状态。
总之,绝大部分一氧化碳中毒患者应接受HBOT,直至COHB水平降至≤3%或临床症状完全消失。此外,HBOT与患者急性期和1年内死亡率降低有关,
肺部光疗
光疗可选择性地从血红蛋白中解离一氧化碳,而不影响血红蛋白对氧的亲和力,并在复苏的早期阶段提高血浆乳酸清除率波长为800—1060nm的低能级激光可促进氧合血红蛋白中氧的释放,并改善毛细血管向周围组织的氧供。直接肺部光疗法可有效促进COHB中一氧化碳的解离,使COHB半衰期降低38%,内膜内光纤传导可在不开胸的情况下提高一氧化碳的清除率,使COHB半衰期降低16%,化学发光可作为治疗一氧化碳中毒的替代光源,通过化学发光反应在胸膜腔产生光线,提高一氧化碳清除率,使COHB的半衰期降低12%,但由于人体肺表面积较大以及光的穿透性等因素,导致肺光疗法尚不能用于人类一氧化碳中毒的治疗,非侵入性的光传输方法(替代光源、光纤传递)在小鼠一氧化碳中毒的成功应用将为人类一氧化碳中毒的治疗提供新策略。
丁基苯酞
丁基苯酞能有效改善慢性、间歇性低氧血症引起的认知功能障碍,保护细胞免受缺血缺氧性损伤,同时还能维持线粒体功能、平衡抗凋亡基因与促凋亡基因的水平,钙蛋白酶是一种钙激活的半胱氨酸蛋白酶,广泛表达于细胞线粒体中,间歇性缺氧可显著增加钙蛋白酶1的活性,升高机体ROS和Ca2+的水平,造成细胞内Ca2+稳态失衡,导致细胞存活率下降,功能破坏,丁基苯酞可以平衡钙蛋白酶1的表达,通过维持海马超微结构的完整性改善认知功能,可能在一氧化碳中毒大鼠的脑组织中发挥神经保护的作用,Xiang等研究表明丁基苯酞并不会增加药物性肝损伤和肝肾功能衰竭的发生,同时不会显著影响体内的血糖和血脂水平,另有研究表明,丁基苯酞联合间充质干细胞治疗DEACMP更加有效。因此,丁基苯酞对于改善一氧化碳中毒患者的认知功能有极大的帮助。
治疗DEACMP的药物
地塞米松
糖皮质激素具有强烈的抗炎作用,可抑制人体免疫系统MBP由少突胶质细胞分泌,并在髓鞘表面表达是中枢神经细胞的主要成分,一氧化碳中毒可导致MBP水平变化和抗原改变,发生抗原抗体反应.自发免疫反应可诱导急性DEACMP的发生地塞米松可通过抑制免疫应答反应预防脱髓鞘疾病并防止DEACMP的发生Li等的研究表明:与单独HBOT相比,地塞米松联合HBOT可显著降低一氧化碳中毒小鼠体内的MBP水平,Xiang等的研究发现,与只接受HBOT的DEACMP患者相比,接受HBOT联合5mg/d或10mg/d地塞米松治疗患者的简易智力状态检查量表评分显著升高(P=0.037)。美国国立卫生研究院卒中量表评分和脑脊液中MBP的水平显著降低,且未显著增加不良事件的发生率。因此,地塞米松可以作为DEACMP的预防用药及潜在的治疗用药.
乙酰胆碱酯酶抑制剂
烟碱胆碱能系统可能对DEACMP有影响Ochi等发现DEACMP大鼠海马烟碱乙酰胆碱受体3的表达显著减少,小脑乙酰胆碱受体的表达显著增加。因此AChEI可增强海马乙酰胆碱能神经元的功能,从而防止一氧化碳再激活导致的神经元迟发性死亡。此外,AChEI具有多效性,通过在皮质和海马神经元中发挥抗细胞凋亡作用,增加B细胞淋巴瘤/白血病-2的表达,刺激烟碱乙酰胆碱受体,激活磷脂酰肌醇-3-激酶/蛋白激酶B途径,抑制糖原合酶激酶-3表达从而起到神经保护作用,Yangiha等报道了2例老年女性DEACMP患者,经AChEI治疗后认知功能得到改善。因此,AChEI可能是DEACMP的潜在治疗药物之一。
萝卜硫素
神经细胞凋亡是一氧化碳中毒后急性脑梗死和DEACMP的重要机制之一,目前已知的调节细胞凋亡的通路有线粒体通路、死亡受体通路和内质网通路,其中线粒体通路是最常见的凋亡信号通路,萝卜硫素是抗氧化剂,可增强线粒体功能,尤其是产生ATP的能力,研究发现中剂量的萝卜硫素可显著改善一氧化碳中毒大鼠的认知功能,增强抗氧化防御,减轻线粒体超微结构损伤,从而对急性一氧化碳中毒导致的脑损伤发挥积极作用,故萝卜硫素可能成为治疗DEACMP的新方案之一。
粒细胞集落刺激因子
一氧化碳中毒可导致血液中G-CSF明显增加,G-CSF被认为是一种新型神经细胞保护剂。研究发现,G-CSF可通过刺激血红素加氧酶-1的表达发挥抗炎、抗氧化作用。同时,G-CSF还可以刺激髓鞘再生,改善一氧化碳中毒造成的血脑屏障通透性增高,保护中枢神经系统。此外,G-CSF通过刺激Janus激酶2-信号转导及转录激活因子3和磷脂酰肌醇-3-激酶/蛋白激酶B途径,抵抗一氧化碳中毒后因心肌缺血所致的凋亡途径,Hashemzaei等的研究也证明,在一氧化碳中毒后连续5d给予100μg/kg的G-CSF与对照组相比,在总蛋白没有明显差异的情况下G-CSF组磷酸化蛋白(包括磷酸化Janus激酶2、磷酸化信号转导及转录激活因子3和磷酸化蛋白激酶B1)明显增多表明G-CSF通过激活抗凋亡途径以及刺激磷酸化蛋白生成来减少细胞凋亡。但目前G ̄CSF在临床试验中的应用相对较少,G-CSF在DEACMP中的作用需要进一步研究证实。
亚甲蓝
亚甲蓝可以将线粒体电子传递链中的电子直接从还原型烟酰胺腺嘌呤二核苷酸传递到细胞色素C,增加复合物Ⅳ的活性,从而提高线粒体活性,亚甲蓝也可适当调节线粒体裂变和融合,有助元死亡,研究发现,一氧化碳暴露1h后,亚甲蓝处理大鼠的海马神经元损伤减轻,空间学习记忆能力提高,而亚甲蓝处理DEACMP大鼠的促炎细胞因子水平降低,氧化损伤受到抑制,线粒体功能得到保护,但由于DEACMP的确切机制尚不清楚,亚甲蓝作为DEACMP的一种潜在治疗药物还需要进一步研究。
促红细胞生成素EPO可以抑制一氧化碳中毒引起的炎症反应。研究表明,一氧化碳中毒后,EPO治疗能够抑制TO11样受体4和核因子κB炎症信号通路降低TO11样受体和核因子κB以及海马组织中肿瘤坏死因子 ̄α、白细胞介素 ̄1β和白细胞介素 ̄6的水平可改善一氧化碳中毒引起的组织学水肿和神经元坏死,减少脑损伤。另有研究发现EPO治疗大鼠脱髓鞘纤维较未经EPO治疗大鼠少,说明EPO可阻止一氧化碳介导的氧化应激反应中MBP的化学改变可见,EPO可通过多条途径减少一氧化碳中毒所造成的脑损伤,故EPO可能引入临床DEACMP的治疗。
依达拉奉
一氧化碳可上调一氧化氮合酶的表达,促进一氧化氮大量生成,而过量一氧化氮可导致过氧亚硝酸盐的产生,进而作为一种病理性自由基损害线粒体功能电子显微镜显示:一氧化碳中毒后细胞染色质浓缩、细胞质溶解、空泡形成、细胞核膜和细胞器分解证实了一氧化碳中毒可诱导细胞凋亡,而凋亡细胞广泛分布于皮质、纹状体和海马中,依达拉奉作为自由基清除剂可用于一氧化碳中毒的治疗,可明显抑制细胞凋亡改善神经生理变,并可用于DEACMP的治疗。